Ao estudarmos as diferentes substâncias constituídas exclusivamente por ligações covalente, não tarda encontrarmos situações nas quais a regra do octeto é "ludibriada" ou até mesmo ignorada. Antes de chegarmos a eles, apresentarei alguns exemplos de estruturas com átomos de três ou mais elementos.
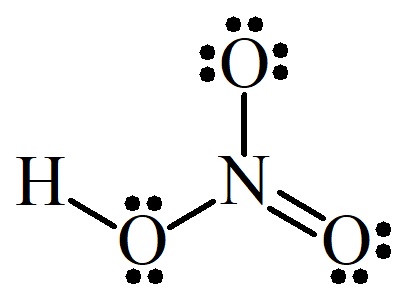
Ácido nitroso (HNO₂):
Note que o nitrogênio (N) precisa fazer três ligações, cada oxigênio (O) precisa de duas e o hidrogênio (H) precisa de uma ligação. Todas elas covalentes, não custa lembrar. Nestas situações é necessário saber que os átomos de oxigênio evitarão ligações entre si, a menos que se trate de um peróxido ou superóxido, alguém lhe avisará quando for um deles. A única configuração possível sem ligações entre átomos de oxigênio é a que vemos acima.
Ácido hipobromoso (HBrO):
No que o hidrogênio e o bromo (Br) fazem uma ligação cada e o oxigênio faz duas. Nada mais justo que o oxigênio se ligar a cada um deles. Certo?
Ácido hipossulfuroso (H₂SO₂):
Está é uma que não existe na prática, mas servirá de referência para o que desejo mostrar. Assumindo que o enxofre (S) faz duas ligações e cada oxigênio também, com o hidrogênio fazendo apenas um ligação, a imagem acima seria a única forma de eles se combinarem sem que os átomos de oxigênio se liguem.
Tricloreto de fósforo (PCl₃):
Cada átomo de cloro (Cl) necessita de apenas uma ligação para cumprir a regra do octeto e o fósforo (P) precisa de três, fica meio óbvio o que fazer. Note que, com exceção do hidrogênio, em todos os caso citados até agora, a soma de ligações e de pares de elétrons não ligantes é quatro. Como se compartilha um par na ligação e um par são duas unidades, cada átomo tem para si oito elétrons.
E se eu disser que existem as seguintes substâncias: HNO₃, HBrO₂, HBrO₃, HBrO₄,H₂SO₃, H₂SO₄ e PCl₅. Como montar suas fórmulas estruturais sem quebrar a regra do octeto e sem átomos de oxigênio se ligarem uns aos outros? Veja caso a caso:
Ácido nítrico (HNO₃):
Se você comparar exatamente com a estrutura do HNO₂, notará que o terceiro átomo de oxigênio se ligou ao nitrogênio onde antes havia um par de elétrons não ligantes do nitrogênio. Mais ainda, este terceiro átomo de oxigênio possui um total de três pares de elétrons não ligantes e apenas uma ligação covalente. A regra do octeto se encontra intacta, mas esta ligação é um pouco diferente da ligação simples. Trata-se de uma ligação covalente coordenada, antigamente chamada de dativa. Nela o par de elétrons compartilhado tem sua origem em apenas um dos átomos que a compartilham. Como o oxigênio não usou qualquer um de seus seis elétrons, eles permanecem como elétrons não ligantes.
Então é isto que veremos nos próximos casos? Não. A ligação covalente coordenada é realizada em situações bem específicas. O átomo "fornecedor" do par de elétrons tem de pertencer a um elemento do segundo período da tabela periódica. Se pertencer a um dos períodos abaixo, ele fará uma expansão de sua regra do octeto, tendo uma soma superior a oito elétrons entre ligantes e não ligantes. Veja os exemplos:
Ácido bromoso (HBrO₂):
Ácido brômico (HBrO₃):
Ácido perbrômico (HBrO₄):
Originalmente o átomo de bromo possuía três pares de elétrons não ligantes quando fazia parte do HBrO e um total de oito elétrons, dois ligantes e seis não ligantes. À medida que átomos de oxigênio são adicionados à estrutura, eles se ligam por ligação dupla ao átomo de bromo, que passa a ter 10, 12 e 14 elétrons ao todo no HBrO₂, HBrO₃ e HBrO₄, respectivamente.
O raciocínio é semelhante para os compostos de enxofre:
Ácido sulfuroso (H₂SO₃):
Ácido sulfúrico (H₂SO₄):
Note que o enxofre teria oito elétrons em sua última camada caso seja parte no H₂SO₂, mas tem dez elétrons no H₂SO₃ e doze elétrons no H₂SO₄. Neste último caso, todos eles compartilhados com átomos de oxigênio, ou seja, seus seis elétrons da camada de valência compartilhados com outros seis elétrons das camadas de valência de outros quatro átomos de oxigênio. Isto só é possível expandindo a regra do octeto. E como eles fazem isto? Não aprofundarei em detalhes, mas eles usam subníveis vazios da camada de valência, no caso o subnível "d". Átomo de elementos do segundo período não possuem esse subnível disponível, mesmo que vazio, na segunda camada, por isto resta a eles a ligação coordenada. Veja mais dois exemplos de expansão da regra do octeto.
Pentacloreto de fósforo (PCl₅):
Hexafluoreto de enxofre (SF₆):
Em ambos os casos, fósforo e enxofre usam cada um de seus elétrons em suas respectivas camadas de valência em ligações simples com átomo de cloro e flúor, respectivamente. Dessa forma, eles chegam a dez e doze elétrons, expandindo, assim, suas regras do octeto. É possível observar isto com o iodo (I) se ligando a sete átomos de flúor e, pasme, com o xenônio (Xe) se ligando a uma quantidade de átomos de flúor que varia entre dois e oito átomos. Sim, um gás nobre fazendo ligações químicas.
Hepafluereto de iodo (IF₇):
Octafluereto de xenônio (XeF₈):
Não representei os pares de elétrons não ligantes dos átomos de flúor deste último para não ficar mais confuso ainda. Se, por acaso, você se pergunta como ele pode fazer tanta ligação. Lembre-se que, com um subnível "d" vazio, ainda há vaga para outros dez, ele pode compartilhar todos os seus oito elétrons com oito de outros átomos e ainda sobra uma vaguinha para mais dois.
Retornando à ligação covalente, ela surge em situações para explicarmos certas substâncias como o monóxido de carbono, o ozônio e as isonitrilas, uma classe de compostos orgânicos.
Monóxido de carbono (CO):
Há uma ligação dupla e uma ligação covalente coordenada entre o oxigênio e o carbono, mas quem forneceu o par compartilhado nesta ligação é o oxigênio. Como sei disso? O oxigênio possui apenas um par de elétrons não ligante e o carbono também possui um, algo que não é lá muito comum. O carbono só compartilhou dois de seus elétrons, por isto dois são não ligantes.
Ozônio (O₃):
Aqui há mais ainda do que pretendo explicar, mas, de forma resumida, um átomo de oxigênio se liga por dupla a um e fornece um par de elétrons para outra coordenada com o da direita.
Isonitrila (CH₃NC):
Entre o carbono da direita e o nitrogênio existe exatamente a mesma relação que entre o carbono e o oxigênio no monóxido de carbono. Veja o par de elétrons não ligante dele.
Esta parte encerra por aqui. Tem algum caso que você queira saber? Comenta aí, ou eu crio uma postagem nova, ou eu aumento esta aqui. Até a próxima.

















Nenhum comentário:
Postar um comentário
Devido a brincadeiras de mal gosto e comentários trolls, os comentários serão moderados a partir de agora. Agradeço a compreensão.