É comum na geometria plana estudarmos os pontos, as retas e as relações entre essas entidades. Na geometria espacial acrescentamos os planos à brincadeira e estudamos as relações entre eles. É claro que fui muito simplista nesta apresentação, pois é isto que faremos ao falar de geometria molecular. Se correta, quanto mais simples for a interpretação para a forma geométrica de uma molécula, mais frequentemente a usaremos.
Eu imagino que passa algo parecido com a imagem acima na cabeça de quem tenta imaginar as formas das moléculas. Mas não precisa ser assim. Existem moléculas com formas unidimensionais, bidimensionais e tridimensionais. Quanto mais dimensões, mais difícil representar e imaginar a estrutura. Antes de apresentar cada caso, lembre-se que, neste tópico, trataremos os átomos como pontos e as ligações covalentes entre eles como retas. Não é o correto diante do que já apresentei em outros momentos, mas é uma boa analogia e ajuda a compreender.
E qual o motivos de usarmos pontos e retas? Para que as moléculas se pareçam com polígonos ou poliedros e possamos classificá-las de acordo com os nomes de tais formas geométricas. Antes de avançarmos, resta apenas um detalhe muito importante neste processo, trataremos com cuidado tanto dos elétrons compartilhados na ligações químicas, quanto dos não compartilhados, chamados, respectivamente, de ligantes e não ligantes.
Esses elétrons se repelem e a consequência de sua repulsão é que ficam o mais distante possível uns dos outros. Influenciando na forma geométrica da molécula. Vamos aos casos:
¬ Estrutura monoatômica: ponto.
Os gases nobres (He, Ne, Ar, Kr, Xe, Rn e Og) são exemplos de substâncias constituídas por partículas constituídas de um único átomo. Não há ligação química alguma e suas partículas (átomos) são tratadas apenas como pontos. Outras substâncias aquecidas à temperatura de um plasma (quarto estado da matéria) sofrem a ruptura de suas ligações químicas e seus átomos também ficam isolados. À temperatura ambiente, apenas os gases nobres apresentam tal comportamento.
¬ Estrutura diatômica: linear.
Duas expressões da geometria plana cabem aqui. Quantas retas passam por um único ponto? Infinitas. Quantas retas passam por dois pontos? Apenas uma. Isto nos ajuda a definir que toda molécula diatômica será linear, não importa se seus átomos são iguais ou diferentes. São exemplos H₂, N₂, O₂, F₂, Cl₂, Br₂ e I₂ entre as substâncias simples. HF, HCl, HBr, HI, NO, CO, FCl, FBr, FI, ClBr, ClI e BrI são exemplos entre as substâncias compostas. Não cito aqui o astato (At) e o tenessino (Ts) por serem halogênios radioativo e artificial, respectivamente. Insisto no fato que toda estrutura diatômica é linear pelos conceitos de geometria plana citados acima. Isto faz com que sua representação seja muito simples.
¬ Estrutura triatômica: linear.
Considere a imagem acima meramente ilustrativa. Três pontos distribuídos nos espaço podem formar um triângulo ou podem ser colineares. Quando três átomos são colineares, dizemos que a geometria da molécula é linear. Isto acontece com o dióxido de carbono (CO₂) e ácido cianídrico (HCN), assim como seus derivados halogenados ClCN, FCN, BrCN e ICN. Até mesmo com o HNC e o BeH₂. Sim, o berílio é capaz de formar ligações covalentes, é o mais eletronegativo entre os metais.
Note que, em todos os casos acima, o átomo central não possui pares de elétrons não ligantes. Isto permite que os átomos ligados ao átomo central fiquem o mais distante possível entre si, com as ligações em linha. Observe também que a natureza das ligações não interessa, ou seja, se é ligação simples, dupla ou tripla. O importante é a quantidade de nuvens eletrônicas distribuídas ao redor do átomo central, uma nuvem eletrônica pode ser uma ligação tripla ou uma simples.
Outra situação pouco comum ocorre quando o átomo central possui um excesso de pares de elétrons não ligantes. Mais precisamente três, pode ocorrer com o XeF₂ e os ânions I₃⁻ e ICl₂⁻.
E como ter certeza que a forma dessas estruturas é linear? Veja a imagem abaixo:
Veja os três átomos em linha e os lóbulos com os pontos indicando os pares de elétrons não ligantes. Nesta circunstância o átomo central possui um total de cinco nuvens eletrônicas.
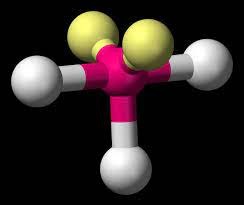
¬ Estrutura triatômica: angular.
Como é de se imaginar pela imagem acima, é possível encontrarmos dois tipos de estruturas moleculares triatômicas, aquelas que o átomo central possui dois pares de elétrons não ligantes e aquelas que o átomo central possui apenas um par de elétrons não ligantes.
Do primeiro grupo, a água (H₂O) e o ácido sulfídrico (H₂S) são exemplos, assim como os semelhantes de sua coluna na tabela periódica, H₂Se e H₂Te, ácidos selenídrico e telurídrico.
Os ácidos hipocloroso (HClO), hipobromoso (HBrO) e hipoiodoso (HIO) seguem a mesma linha, mas com estrutura não simétricas. Os ânions derivados da perda de hidrogênio por parte dos ácidos cloroso (HClO₂), bromoso (HBrO₂) e iodoso (HIO₂) também são exemplos.
Do segundo grupo temos como exemplos o ozônio (O₃), o anidrido sulfuroso (SO₂) e o ânion derivado da ionização do ácido nitroso (HNO₂).
Insisto, a presença dos pares de elétrons não ligantes afetam e muito o ângulo entre as ligações. Na água este ângulo é de 104,5°, no ozônio é de 116,8°. Mas o tamanho do átomo central contribui para isto, no ácido sulfídrico (H₂S) é de 92,1°, no anidrido sulfuroso (SO₂) é de 119°.
¬ Estrutura tetratômica: linear.
São pouquíssimos os exemplos de quatro átomos colineares em uma molécula. Existe com certeza o etino (C₂H₂), também chamado de acetileno e o hipotético C₂N₂, que pode existir de duas formas. De qualquer forma, é necessário que os dois átomos centrais tenham apenas duas nuvens eletrônicas sem pares de elétrons não ligantes.
Observe que no C₂N₂ de baixo existe uma ligação covalente coordenada entre o carbono e o nitrogênio, sendo que é este quem forneceu o par de elétrons compartilhado nela.
¬ Estrutura tetratômica: triangular plana.
Também chamada de trigonal plana, pelo fato de os átomos periféricos formarem um triângulo ao redor do átomo central. Também é necessário que este átomo central tenha apenas três nuvens eletrônicas sem par de elétrons não ligantes. São exemplos estruturas constituídas de boro, como o trifluoreto de boro (BF₃) e o trihidreto de boro (BH₃), também chamado de borano. Outras combinações de boro com átomos monovalentes também obedecem esta geometria.
Se os átomos periféricos são idênticos, os ângulos entre as ligações são de 120°, como os ângulos entre os raios que partem do centro para os vértices em um triângulo equilátero inscrito em uma circunferência. Se os átomos periféricos são diferentes, esses ângulos podem ser próximos de 120°, mas não terão este valor.
O ânion nitrato, derivado da ionização do ácido nítrico (HNO₃) também possui esta geometria.
¬ Estrutura tetratômica: trigonal piramidal.
Também chamada de triangular piramidal, os átomos periféricos formam a base de uma pirâmide em relação ao átomo central. E o que os obriga a não ficar no mesmo plano que o átomo central? Um par de elétrons não ligantes do átomo central. Com isto, ele tem um total de quatro nuvens eletrônicas e as distribui ao seu redor o mais distante possível umas das outras, por isto apresenta um nome que remete a algo tridimensional.
São exemplos dessa geometria a amônia (NH₃) e o tricloreto de fósforo (PCl₃). Variações de nitrogênio ou fósforo ligados a três átomos monovalentes, idênticos ou não, configuram esta geometria.
Na amônia o ângulo entre as ligações é de 107°, na fosfina (PH₃), esses ângulos são de 93,5° e no tricloreto de fósforo são de 100°.
São também exemplos de geometria piramidal os ânions derivados da ionização completa dos ácidos sulfuroso (H₂SO₃), clórico (HClO₃), brômico (HBrO₃) e iódico (HIO₃).
¬ Estrutura tetratômica: forma de T.
Esta não é das mais comuns. Ocorre quando um átomo de halogênio expande sua regra do octeto e faz três ligações com dois pares de elétrons não ligantes, totalizando cinco nuvens eletrônicas. ClF₃ e BrCl₃ são dois exemplos.
Os dois pares de elétrons não ligantes estão no mesmo plano que a ligação na horizontal. Este plano é perpendicular às duas ligações na vertical, por isto a forma de T.
Em amarelo estão os dois pares de elétrons não ligantes.
¬ Estrutura pentatômica: tetraédrica.
Quando o átomo central se liga a quatro átomos periféricos idênticos sem que sobre par de elétrons não ligantes, os átomos periféricos se distribuirão simetricamente de tal maneira que eles formem um tetraedro regular. Observamos esta geometria com átomos de carbono (CH₄, CF₄, CCl₄) e de silício (SiH₄). Caso os átomos periféricos não sejam idênticos, o tetraedro formado não será regular.
Entre os íons, amônio (NH₄⁺), tetrafluorborato (BF₄⁻) e íons derivados da ionização completa dos ácidos fosfórico (H₃PO₄), sulfúrico (H₂SO₄), perclórico (HClO₄), perbrômico (HBrO₄) e periódico (HIO₄) são exemplos de estruturas tetraédricas.
¬ Estrutura pentatômica: gangorra.
Esta geometria ocorre quando o átomo central possui um total de cinco nuvens eletrônicas, sendo que apenas uma delas é um par de elétrons não ligantes. Ela ocorre em casos de expansão da regra do octeto, como no tetrafluoretro de enxofre (SF₄), seu análogo de selênio (SeF₄) e do cátion IF₄⁺.
O enxofre possui seis átomos na camada de valência, ele compartilha quatro deles e o par restante é não ligante. No cátion IF₄⁺ é necessário observar que o iodo possui originalmente sete elétrons na camada de valência. Ao perder um deles fica situação similar à do enxofre ou do selênio, forma quatro ligações covalentes usando quatro de seus seis elétrons restantes e o par não usado atua como não ligante.
Em verde é o par de elétrons não ligantes.
¬ Estrutura pentatômica: quadrática plana.
Quando o átomo central possui quatro ligações e dois pares de elétrons não ligantes, as quatro ligações tentem a se distribuir em um plano e os dois pares de elétrons ocupam posições acima e abaixo deste plano. O XeF₄ e o BrF₄⁻ são exemplos desta geometria.
Observe na imagem abaixo a disposição dos orbitais dos pares de elétrons não ligantes.
¬ Estrutura hexatômica: bipiramidal.
Neste caso o átomo central possui cinco nuvens eletrônicas e todas elas são ligações químicas. PCl₅, PBr₅ e PBr₃F₂ são exemplos desta configuração.
¬ Estrutura hexatômica: piramidal quadrada.
Neste caso o átomo central possui um total de seis nuvens eletrônicas e apenas uma delas é um par de elétrons não ligantes. BrF₅ e IF₅ são exemplos.
Observe que o par de elétrons não ligante está em oposição à ligação na vertical.
¬ Estrutura heptatômica: octaédrica.
Neste caso o átomo central possui seis nuvens eletrônicas e todas elas são ligações químicas. A forma geométrica de modo que os átomos periféricos fiquem equidistantes do central é aquela na qual eles ocupam os vértices de um octaedro regular. O hexafluoreto de enxofre (SF₆) e o ânion PF₆⁻ são exemplos.
¬ Estrutura octatômica: bipiramidal pentagonal.
O átomo precisa fazer sete ligações químicas sem par de elétrons não ligantes para formar esta, observamos ela no heptafluoreto de iodo (IF₇).
¬ Estrutura eneatômica: antiprismática.
Se você encontrar um átomo capaz de formar oito ligações covalentes com oito átomos periféricos idênticos, eles se distribuirão no espaço ao redor do átomo central de forma simétrica. E a figura geométrica resultante disto não é um cubo, é um anti-prisma de base quadrada. O octafluoreto de xenônio é um exemplo.
Caso você não tenha compreendido bem como é um antiprisma, veja as duas imagens abaixo:
Ele possui duas bases quadradas neste caso e as faces laterais são triângulos, fazendo com que os vértices de suas bases fiquem exatamente desalinhados, diferente dos prismas.
Outra forma de apresentar este conteúdo é com uma tabela na qual temos o total de nuvens eletrônicas do átomo central, então a dividimos e pares de elétrons ligantes e não ligantes. Veja:
Nesta tabela, TNE significa total de nuvens eletrônicas, é a soma de pares de elétrons não ligantes e grupos de ligações químicas. QLA significa quantidade de ligações agrupadas, nela uma ligação tripla conta o mesmo que uma simples ou uma dupla ou uma coordenada. PENL significa pares de elétrons não ligantes.
Como você deve ter imaginado, o céu é o limite para as geometrias moleculares. Existem muitas outras envolvendo metais formando compostos de coordenação nos quais eles fazem ligações covalentes coordenadas, como a hemoglobina, por exemplo. Mas encerrarei por aqui. Eventualmente apresentarei outras. Se tiveres alguma dúvida, já sabe... comenta aí... até a próxima.
















































Nenhum comentário:
Postar um comentário
Devido a brincadeiras de mal gosto e comentários trolls, os comentários serão moderados a partir de agora. Agradeço a compreensão.