A partir do momento que sabemos a diferença entre uma substância pura e uma mistura e o significado de suas propriedades específicas, podemos aprofundar um pouco no que diz respeito a temperaturas de fusão e ebulição. É provável que você tenha notado o fato de que, sempre ao informar o valor de temperatura d fusão de uma substância, eu tomei o cuidado de informar em qual altitude. O mesmo valendo para a temperatura de ebulição e também para a de sublimação.
Isto acontece pelo fato de as temperaturas de mudança de estados físicos serem dependentes da pressão ambiente. Se a pressão que a vizinhança exerce sobre o sistema se altera, a temperatura para mudar de estado físico também sofrerá alteração.
Exemplo: no topo do monte Everest a pressão ambiente é menor, pois a atmosfera é rarefeita. A temperatura de ebulição da água cai para quase 70 °C. Por outro lado, dentro de uma panela de pressão, ao nível do mar, a água pode chegar 120 °C e ainda está líquida. Note que a panela de pressão precisa estar ao nível do mar, ou mais próxima possível, para ser eficiente.
E se usarmos uma panela de pressão no topo do monte Everest? Aí a temperatura de ebulição da água dentro da panela será maior que 70 °C, mas não chegará aos 120 °C, ficando bem abaixo disso.
Para compreender melhor toda esta relação, os cientistas se deram ao trabalho de montar gráficos com esta relação entre pressão e temperaturas nas quais as substâncias mudam de estados físicos. Chamamos eles de Diagramas de Fases:
Nele fica clara a diferença entre três regiões correspondentes aos três estados físicos mais citados: sólido, líquido e gás. Ainda não as reconheceu? Então veja a próxima figura.
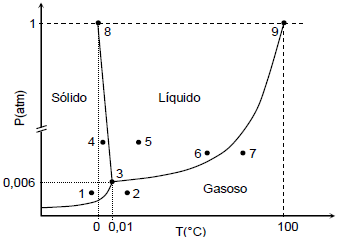
As três curvas
Cada curva corresponde a duas mudanças de estados físicos: fusão e solidificação para a que separa o sólido do líquido, ebulição e condensação para a que separa o líquido do gás, sublimação e ressublimação para a que separa o gás do sólido.
O Ponto Triplo
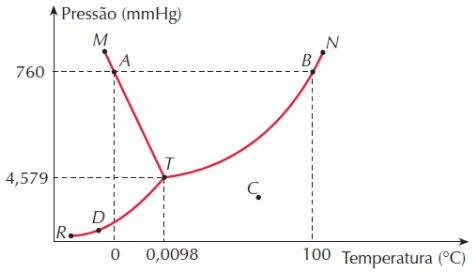
Marcado por T no gráfico de cima e por 3 no de baixo, este ponto é aquele no qual se encontram as três curvas que separam os estados físicos dois a dois. Pode parecer bobo o que informarei agora, mas é algo bem incomum. É neste ponto triplo que coexistem os três estado físicos da matéria em equilíbrio.
Isto significa que, se mantivermos a pressão e a temperatura em aproximadamente 0,006 atm e 0,01 °C, respectivamente, os três estados físicos permanecerão. Você pode até alegar que faz isso em casa, mas se esperares o tempo passar um pouco, logo um deles se transforma em um dos outros dois.
Cada substância possui um ponto triplo. Muitas delas possuem ponto triplo com pressão bem abaixo da pressão ao nível do mar. É por isso que a vemos passarem por fusão e ebulição. Aquelas que o ponto triplo possui pressão acima da pressão do nível do mar sofrem ebulição. um exemplo é o gás carbônico.
O Ponto Crítico
Antes de irmos próximo gráfico, quero a sua atenção à seguinte sequência de etapas, observe com atenção.
Considere uma certa massa de água a 50 °C a uma altitude acima do nível do mar (A), se aquecermos ela, eventualmente sua temperatura aumentará e ela para para o estado gás a uma pressão correspondente a esta altitude (B).
Se esta massa gasosa for mantida em um recipiente e aumentarmos a pressão sobre ela, mantendo a temperatura constante, eventualmente ela passará ao estado líquido (C). Mas se aumentarmos a temperatura com a nova pressão constante, passará ao estado de gás mais uma vez (D).
Confuso? Então veja as linhas amarelas no gráfico abaixo:
Aplicações Tecnológicas
Duas aplicações tecnológicas que nem sonhamos estão intimamente relacionadas com o domínio do conhecimento dos diagramas de fases das substâncias, uma delas passa longe do nosso cotidiano, mas a outra está muito presente em nossa vida.
A Liofilização
Você já deve ter comido frutas secas ou algum alimento desidratado. Algo como macarrão que ferve por cinco minutos e está pronto para a refeição. Pois é, passaram pelo processo de liofilização: foram resfriados a uma temperatura abaixo do ponto triplo da água e então a pressão foi reduzida também abaixo do ponto triplo.
Assim a água sofre sublimação e o alimento conserva boa parte de suas propriedades. Tais propriedades seriam perdidas se o alimento fosse cozido para a água evaporar. Tem um vídeo bacana do manual do mundo sobre isto.
Já falamos sobre o ponto crítico, uma substância que se encontra em circunstâncias além deste ponto é chamada de fluido supercrítico. Neste estado ele conserva características de gás e de líquido ao mesmo tempo. Podendo ser estocado com mais segurança em um ônibus ou estação espacial, caso do oxigênio. Imagine um tanque com oxigênio líquido exposto à luz do sul e aquecido, as bolhas produzidas podem comprometer a estrutura que o contém. Com o fluido supercrítico isto não acontece.
Aqui tem um vídeo de quatro minutos mostrando como um fluido supercrítico de dióxido de carbono se comporta. Espero que ajude.
Patinando no gelo
Os patins de gelo possuem lâminas bem afiadas a ponto de a pessoa que os calça exercer considerável pressão sobre o gelo. Tal pressão faz com que a água sólida passe para o estado líquido. Semelhante ao que foi falado para se obter o fluido supercrítico. Pois a pressão aumenta mantendo a temperatura constante.
Uma vez que o gelo derrete, a fina camada de água formada permite ao metal deslizar sobre ela, voltando ao estado sólido assim que o metal sai de cima. Deixando uma marca, como se vê pela imagem abaixo.




Nenhum comentário:
Postar um comentário
Devido a brincadeiras de mal gosto e comentários trolls, os comentários serão moderados a partir de agora. Agradeço a compreensão.