O modelo atômico de Bohr explica como é a
eletrosfera do átomo. Esta explicação se dá em termos de como os elétrons
interagem com a luz. Antes de aprofundarmos no modelo de Bohr, faremos um
apanhado de certos eventos, conceitos e personagens que contribuíram de forma
direita ou indireta para o trabalho de Bohr. O processo será um pouco demorado,
mas eu acredito que vale a pena, então senta que lá vem a história.
CONTEXTO HISTÓRICO
Desde a antiguidade a humanidade se intriga e tenta
explicar a natureza da luz. Ptolomeu, um filósofo grego, foi o primeiro a
deixar algum registro sobre fenômenos envolvendo a luz. Seu trabalho recebeu o
nome de “Óptica” e abordou temas como a reflexão e refração da luz e buscou um
melhor entendimento sobre a origem das cores.
Fenômeno da refração e como ele afeta a nossa
compreensão de onde o peixe está.
Para não estender muito o assunto, é necessário compreender o fato de a refração ser um desvio sofrido pela luz quando esta passa de um meio transparente para outro. Tal desvio provoca ilusões de ótica como o da imagem abaixo.
Fenômeno de refração da luz.
1ª lei de Snell: o
raio incidente (i), o raio refratado (r) e a reta normal são coplanares.
A aparente deformação sofrida pela colher é apenas uma ilusão causada pelo desvio dos raios de luz quando saem da água para a atmosfera. Coube a Snel, já nos anos dez do século XVII, relacionar esse desvio com uma propriedade conhecida por índice de refração. A relação ficou conhecida por lei de Snel.
O trabalho de Snell consistiu de duas leis. A
primeira lei fala sobre os raios de luz envolvidos e a superfície que separa os
dois meios. A segunda lei estabelece uma relação matemática entre os índices de
refração dos dois meios envolvidos e os ângulos dos raios incidente e refratado.
Willebrord Snellius (Snel)
Uma vez que o fenômeno da refração foi traduzido em termos matemáticos, coube a Isaac Newton inaugurar, em 1665, aquilo que hoje chamamos de espectroscopia: o estudo de propriedades da matéria a partir da interação dela com a luz, seja por absorção, reflexão, refração, difração ou espalhamento.
Experimento de Newton de decomposição da luz branca.
Newton desmembrou a luz branca e natural em suas componentes coloridas, como no arco-íris. Além disso, ele observou como as cores individualmente não se decompunham ao passar pelo prisma. Mas se combinadas em lentes, formavam de volta a luz branca. Posteriormente, concebeu um disco com as setes cores (vermelho, laranja, amarelo, verde, azul, violeta e anil) em formato de fatias de pizza. Tal disco, sob rotação constante, apresenta-se branco.
Disco de Newton
Em 1800, Herschel descobriu o infravermelho ao medir a temperatura de cada uma das regiões atingidas por uma das cores.
Friedrich Wilhelm Herschel
Herschel teve a iniciativa e grande sacada, diga-se de passagem, de posicionar termômetros na regiões vizinhas ao vermelho.
Experimento de Herschel
Uma alteração de temperatura foi notada no termômetro da região próxima ao vermelho, porém, sem cor alguma. Estava ali descoberto o infravermelho e o fato de a luz não ser constituída apenas de algo visível. Mas o termo infravermelho só viria a aparecer mais tarde, "raios de calor" foi o termo utilizado.
Não demorou muito e, em poucos meses, Ritter descobriu o que hoje chamamos de ultravioleta. Ao expor sais de prata ao espectro visível da luz, ele verificou a decomposição (perceptível pelo escurecimento) desses sais na região incolor vizinha ao violeta. Para não ficar confuso, é semelhante ao que acontece com a maça quando exposta à luz do sol.
Escurecimento da maçã quando exposta à luz do sol.
O termo ultravioleta também não foi atribuído naquele momento, Ritter os chamou de raios desoxidantes, pois reduziram a prata do sal a prata metálica. O termo teve apenas a função de enfatizar sua reatividade química e diferenciá-los dos raios descobertos por Herschel.
No início do século XIX, quando Dalton lançou seu
modelo, já se sabia que a luz, além de ser constituída das cores (vermelho,
laranja, amarelo, verde, azul, anil e violeta) do arco-íris, também era
constituída de algo além do violeta e do vermelho. Hoje chamamos de
ultravioleta e de infravermelho estes tipos de luz não visíveis a olho nu e que
são próximos do visível.
Johann Wilhelm Ritter
Em 1814, um alemão especialista em óptica chamado Fraunhofer desenvolveu um espectroscópio. Tal instrumento permitiu a ele observar o espectro da luz solar com maior nitidez. Em outras palavras, é como se ele fizesse o experimento de Newton e usasse uma lupa para observar com exatidão os detalhes de cada cor projetada sobre a superfície.
Joseph von Fraunhofer
O espectro obtido por Fraunhofer é rico em detalhes. Tantos a ponto de ele notar algo que Newton deixou passar batido. Linhas escuras cortando o espectro em todas as cores, um total de 574 linhas escuras.
Espectro semelhante ao obtido por Fraunhofer para a luz do sol.
É extremamente importante notar neste momento que as faixas escuras representam uma descontinuidade do espectro. Aquelas linhas escuras nos mostram a ausência de algumas frequências na luz vinda do sol. Em sua completude, ou seja, visível e não visível, o espectro completo da luz deveria ser como na figura abaixo:
Espectro da luz visível.
A título de curiosidade, a luz que nossos organismos
utilizam para enxergar corresponde a uma faixa de 300 metros em uma
"estrada" de 10 quatrilhões de metros. Todo o restante corresponde a
faixas não visíveis do espectro da luz.
Neste momento passamos por uma transição no nosso
processo de contextualização histórica do modelo atômico de Bohr. Uma vez que
você compreendeu que a luz é constituída de muito mais que as cores do
arco-íris, é necessário notar que a luz interage com a matéria. Sendo
absorvida, refletida, refratada e emitida, por exemplo. Não são apenas esses
quatro processos citados os únicos, mas servirão como ponto de partida, ou de
continuidade, no nosso processo.
Em 1853, Ångstron observou um gás superaquecido
emitir luz na mesma frequência que ele absorve quando se encontra na
temperatura ambiente. Veja, por exemplo, o caso do gás hidrogênio:
Espectro do hidrogênio.
Há muitas informações na imagem acima, tentemos focar naquilo que mais nos interessa:
1) Espectro de absorção do hidrogênio. Quando uma amostra de gás hidrogênio à temperatura ambiente é atravessada por uma parte do espectro da luz, verificamos que, do outro lado, não chegam as frequências correspondentes à linhas verticais escuras.
2) Espectro de emissão do hidrogênio. Se aquecemos uma amostra de gás hidrogênio, ele emite luz em comprimentos de onda bem específicos. Como as labaredas amarelas de papel em combustão, ou as azuis em caso de álcool etílico ou gás de cozinha em combustão. As frequências correspondentes à emissão do hidrogênio na região visível do espectro da luz são exatamente aquelas cinco indicadas.
O mais curioso nesta história toda. As linhas presentes no espectro de emissão correspondem exatamente às que faltam no espectro de absorção. Ponto para o Ångstron.
Anders Jonas Ångstron
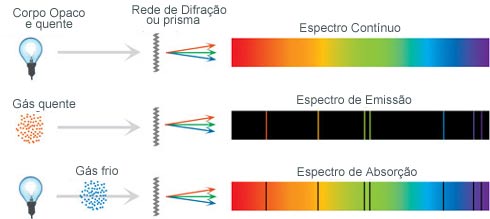
Também em 1853, Kirchhoff propôs as leis da emissão de radiação descrevendo a emissão de luz por objetos incandescentes:
I) Um sólido aquecido emite luz com espectro contínuo.
II) Um gás tênue produz luz com linhas espectrais em frequências específicas que dependem da composição química do gás, ou seja, depende dos elementos e de seus átomos ali presentes.
III) Um objeto sólido a altas temperaturas e rodeado por uma gás tênue a baixas temperaturas produz um espectro com vazios em frequências específicas que dependem da composição química do gás.
Resumo das leis de Kirchhoff
Em outras palavras, depende das substâncias que
formam a mistura gasosa. Estas, por suas vezes, dependem de quais são os
elementos que as constituem.
Gustav Robert Kirchhoff
De posse das ideias de Kirchhoff e de Ångstron é possível montar um equipamento capaz de detectar a luz absorvida por qualquer gás e identificar a qual elemento químico ele pertence ou quais elementos estão presentes nele. Abaixo temos um diagrama simples mostrando os princípios sob os quais ele funciona:
Diagrama de um espetrômetro.
Após estabelecidas a Leis de Kirchhoff e desenvolvidos
os espectrômetros, muitas medidas espectroscópicas foram realizadas para os
mais diversos elementos. Nos permitindo identificar o espectro correspondente a
cada um deles.
O hélio foi descoberto de forma independente pelo
francês Pierre Janssen e pelo inglês Norman Lockyer, em 18 de agosto de 1868,
ao analisarem o cromosfera solar durante um eclipse solar ocorrido naquele ano,
encontrando uma linha de emissão de um elemento desconhecido. Edward Frankland
confirmou os resultados de Janssen e propôs o nome helium para o novo elemento,
em honra ao deus grego do sol (Hélio).
Joseph Norman Lockyer (1836 a 1920) e Pierre Jules
César Janssen (1824 a 1907).
Após a publicação dos resultados para o elemento hidrogênio, um matemático chamado Balmer encontrou um padrão entre as frequências de absorção observadas. Você pode ir para este link para continuar.





.jpg)











Nenhum comentário:
Postar um comentário
Devido a brincadeiras de mal gosto e comentários trolls, os comentários serão moderados a partir de agora. Agradeço a compreensão.