O sucesso e também o fracasso de um modelo atômico está em sua potencialidade de explicar fenômenos da natureza e esclarecer características microscópicas da matéria a partir de observações de suas propriedades macroscópicas.
Dalton explicou a proporção com que as substâncias reagem, Thomson acrescentou os elétrons para explicar a condução de eletricidade em soluções salinas aquosas. Rutherford, por sua vez, detectou a distinção entre núcleo e eletrosfera, assim como a imensidão de espaços vazios.
Coube a Bohr explicar como se distribuem os elétrons pela eletrosfera, relacionando a estrutura desta com resultados dos experimentos de chama e análises do espectro do Hidrogênio. Para infortúnio (ou não!) de Bohr, o próprio avanço tecnológico mostrou ainda a imperfeição em seu modelo. Novas linhas descobertas no espectro do hidrogênio, chamadas de estrutura fina, mostraram haver mais transições eletrônicas que as preditas por Bohr (link). Sommerfeld propôs uma solução para o problema e não foi o suficiente.
A partir disso, ocorreu uma considerável mudança na maneira como a humanidade interpreta o mundo microscópico dos átomos. Heisenberg e Louis de Broglie entraram em cena com o princípio da incerteza e a dualidade onda-matéria (link) e a ideia de um modelo determinístico para descrever o átomo se tornou distante.
"E o que é determinismo?" Imagino que você deve estar se perguntando. Determinismo é a concepção de que todos os acontecimentos do presente são explicados em função dos acontecimentos anteriores. Em ciência, um movimento retilíneo uniforme ou uniformemente variado nos permitem determinar a posição do corpo em qualquer instante, desde que saibamos sua velocidade (MRU) ou aceleração e velocidade inicial (MRUV). O modelo de Bohr é uma tentativa determinística de descrever o átomo de hidrogênio e espécies hidrogenóides. Tem razoável sucesso para átomos dos metais alcalinos, mas falha em descrever os demais átomos, exceto por encontrarmos linhas espectrais em todos eles e associarmos elas a transições eletrônicas.
É neste cenário que, entre 1925 e 1926, surge um dos figuras com nome mais complicado da história da física: Schrödinger, eu pronuncio algo parecido com "chirôdinguer", mas tenho completa noção de que não é assim.
Erwin Schrödinger (1887 a 1961)
Por acaso o mesmo que "tinha um gato".
Experimento fictício do gato de Schrödinger. Imagem retirada de "Mundo Conectado" (link).
Esta história já rendeu boas piadas e homenagens, inclusive.
E isto tem algo a haver com o modelo do orbital? Tem, mas não vou comentar aqui, só citei para fazer graça mesmo. Primeiro falemos da contribuição de Schrödinger. Ele desenvolveu um formalismo matemático de modo a obter uma função chamada função de onda com o objetivo de descrever o comportamento de um elétron em diferentes circunstâncias, inclusive no átomo de hidrogênio.
A esse formalismo foi dado o nome de Equação de Schrödinger, será que ele fez certinho? Indo ao que interessa, Schrödinger chegou a resultados idênticos aos de Bohr no que diz respeito a energia do elétron em cada uma das camadas eletrônicas, mas por um caminho completamente diferente. Inclusive encontrando a medida encontrada por Bohr para o raio do átomo de hidrogênio, porém com uma interpretação física diferente. Mas esta interpretação não partiu de Schrödinger.
Coube a Max Born interpretar parte do trabalho de Schrödinger em termos de uma função de densidade de probabilidade. De modo que função de onda aplicada ao átomo de hidrogênio nos dê como resultados as regiões do espaço ao redor do núcleo com maior probabilidade de encontrar o elétron. E todas elas então em função do valor calculado por Bohr, mas não correspondem exatamente a ele.
Max Born (1882 a 1970)
E por que não são exatamente ele? Como já foi sugerido, não há como ser determinístico nesta situação, pois afetamos o elétron toda vez que tentamos medir uma propriedade dele. O "máximo" que dá pra fazer é identificar as regiões onde mais temos chances de encontrá-lo dentro da eletrosfera. Estas regiões ficaram conhecidas por orbitais.
Ao resolverem a equação de Schrödinger para o átomo de hidrogênio, várias funções surgem. Das soluções delas surgem os orbitais e suas formas, como vemos a seguir:
Orbitais atômicos dos subníveis "s" (vermelho), "p" (amarelos), "d" (azuis) e "f" (verdes).
Talvez dessa outra forma sejam mais apresentáveis.
Orbitais atômicos dos subníveis "s", "p", "d" e "f", na mesma ordem apresentada anteriormente.
Ah, lembra da proposta de Sommerfeld em subdividir as camadas eletrônicas em subníveis? Não era como ele pensou, mas ele estava no caminho certo. E esta farra de formas esquisita acima representa cada um das regiões onde temos maior probabilidade de encontrar um elétron, também chamadas de orbitais. Vejamos cada um deles.
O orbital "s".
Como se pode notar, o orbital "s" tem forma esférica centrada no núcleo, quanto mais longe do núcleo é a camada, maior é a esfera. Isto significa que o elétron está na superfície dessa esfera? Não! Significa que ele pode estar em quase qualquer lugar dentro dela, exceto o próprio núcleo atômico e outras regiões chamadas de nós.
Todo orbital "s", a partir da segunda camada, possui regiões nodais (nós) em seu interior, também centradas no núcleo e coincidentes com outras esferas. Mas essas esferas interiores não correspondem a camadas interiores, só significa que o elétron pode estar lá também, só não é o mais provável. No caso da imagem acima, temos o orbital "s" da segunda camada.
A esta altura você já deve ter notado que o orbital 7s terá um total de seis nós, ou seja, seis regiões nodais separando sete esferas, todos concêntricos em relação ao núcleo.
O orbital "p".
Orbitais p das camadas L e M por densidade de probabilidade e planos nodais, imagem retirada de "The Orbitron".
Ao interpretar os resultados da equação de Schrödinger para a segunda camada do átomo de hidrogênio, surgem duas soluções distintas, a do orbital "s" e uma outra, que se divide em três, cada uma delas ao longo de um dos três eixos do espaço cartesiano. São dois lóbulos alongados e separados por um plano perpendicular ao eixo, há quem diga que se parecem alteres ou cotonetes. Isto não importa, o relevante aqui é o fato de encontrarmos uma região nodal independente do tamanho. O elétron pode estar em qualquer um dos dois lóbulos.
Duas observações sobre a imagem acima são muito pertinentes.
A primeira delas é que parece termos imagens dos lóbulos sob diferentes perspectivas, então vemos todos os seus cantos. Mas não é isto, trata-se do "px", "py" e "pz", que são os orbitais "p" nas direções dos eixos x, y e z dentro do espaço cartesiano.
A segunda observação é sobre orbitais "p" de camadas além da segunda. Quando comparamos os orbitais maiores com os 2p, percebemos os planos nodais separando eles de forma simétrica e lóbulos menores encaixados dentro dos maiores, como ocorreu com os orbitais "s". É necessário aqui estabelecer esta distinção, região nodal gerando simetria e região nodal separando regiões de tamanhos diferentes.
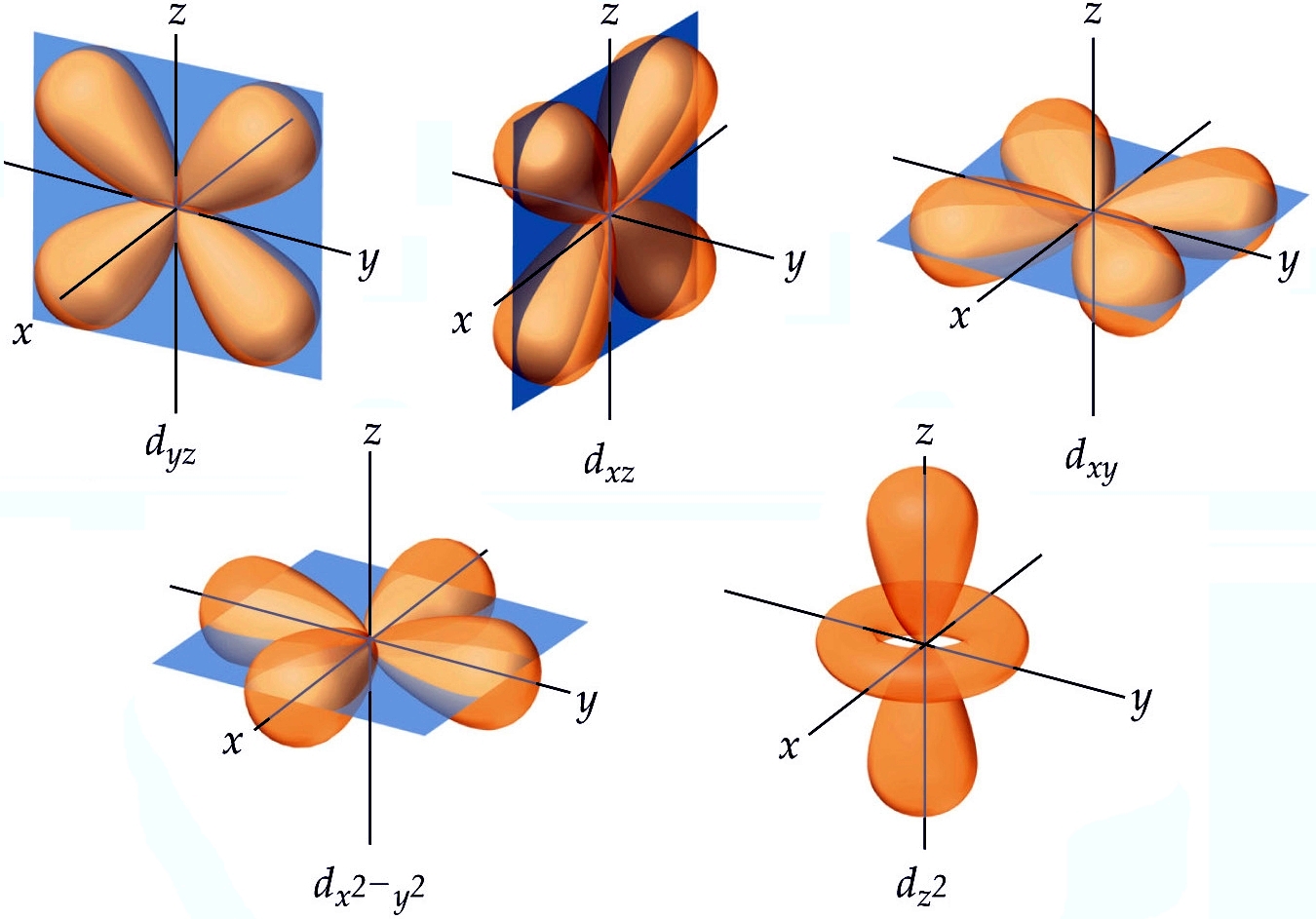
O orbital "d".
| Orbitais 3d. Imagem retirada de "Mente Secular" (link). |
Ao se interpretar os resultados para a terceira camada, encontramos o orbital 3s, os três orbitais 3p nas direções x, y e z e encontramos esses cinco da imagem acima, chamados de orbitais 3d. Quatro deles são bem parecidos entre si e são constituídos de quatro lóbulos cada, separados por dois planos nodais. Tentarei descrever cada um deles abaixo, mas antes vou te lembrar o que é uma bissetriz.
Bissetriz é uma reta que divide um ângulo em dois iguais. Como em um plano formado por dois eixos perpendiculares entre si existem quatro quadrantes, cada um deles tem uma bissetriz.
dyz
Os lóbulos estão nas bissetrizes do plano yz. Os planos nodais são o xy e xz.
dxz
Os lóbulos estão nas bissetrizes do plano xz. Os planos nodais são o xy e yz.
dxy
Os lóbulos estão nas bissetrizes do plano xy. Os planos nodais são o xz e yz.
dx²-y²
Os lóbulos estão sobre os eixos do plano xy. Os planos nodais são formados pelas bissetrizes do plano xy e o eixo z.
dz²
Este é disparado, até aqui, o mais doido de todos. É formado por dois lóbulos ao longo do eixo z e por um toróide (rosquinha) sobre o plano xy. As regiões nodais são amis complicadas ainda de se descrever, mesmo gastando poucas palavras, pois são cones com vértice no encontro dos três eixos.
| Regiões nodais dos orbitais 3d. Imagem retirada de "edisciplinas.usp.br" (link). |
Quando comparamos orbitais "d" de camadas diferentes, o mesmo padrão se estabelece com lóbulos menores dentro de outros maiores com regiões nodais os separando. Mas os mesmos planos separando os conjuntos de lóbulos se mantém.
A esta altura talvez você já tenha notado padrão. Não existem planos nodais nos orbitais "s", apenas um nos orbitais "p" e dois nos orbitais "d". Não precisa ser um gênio da matemática para supor quantos planos nodais separarão os lóbulos de cada um dos orbitais "f".
O orbital "f".
Se encontramos apenas um tipo de orbital "s", temos três orbitais "p", cinco orbitais "d" e sete orbitais "f". Suas quantidade de lóbulos variam entre quatro, seis e oito lóbulos, por uma questão de praticidade eu descreverei apenas dois.
fxyz
São oito lóbulos ocupando os oito octantes do espaço xyz, que são as regiões separadas pelos planos xy, xz e yz. E justamente esses planos citados são as regiões nodais entre eles.
fz³
São dois lóbulos sobre o eixo z e dois toróides, um acima do plano xy e ou abaixo do plano xy. Cada toróide acompanha um lóbulo. Além dos dois cones já citados para o dz², temos uma região nodal no plano xy. Bom, na verdade não são cones, mas veja a imagem abaixo:
Orbitais "f" das camadas N e O e suas três regiões nodais, imagem retirada de "The Orbitron".
Fica agora um resumo de todos os orbitais.
Muito bem, agora você já tem uma pequena noção de "onde" encontrar um elétron dentro do átomo. Essas informações servem como plano de fundo para entender como certas informações surgirão adiante, para que elas não caiam de paraquedas no seu colo. Cada uma delas tem um significado. É disto que você deve se lembrar.
Deixo uma questão a se refletir. Existe uma explicação para essas quantidades de orbitais? Apenas um tipo de "s", três de "p", cinco de "d" e sete de "f". Tem sim, mas abordaremos em outra oportunidade.
Ficou alguma dúvida? Sua cabeça explodiu antes de chegar nos orbitais f? Comenta aí. Até a próxima.















Nenhum comentário:
Postar um comentário
Devido a brincadeiras de mal gosto e comentários trolls, os comentários serão moderados a partir de agora. Agradeço a compreensão.